Strecker-szintézis
Az Adolph Strecker által kigondolt Strecker-szintézis kémiai reakciók sorozata, mellyel egy aldehidből (vagy ketonból) aminosav szintetizálható.[1][2] Aldehidből és ammónium-klorid kálium-cianid jelenlétében végzett kondenzációs reakciójában α-aminonitril keletkezik, melyet hidrolizálva a kívánt aminosav állítható elő.[3][4]
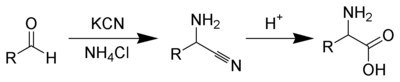
Ammóniumsók felhasználásával szubsztituálatlan aminosav keletkezik, de a szintézis primer és szekunder aminokkal is sikeresen végrehajtható, a termék ekkor a megfelelő szubsztituált aminosav. Ugyanígy aldehidek helyett ketonokból is kiindulhatunk, ebben az esetben α,α-diszubsztituált aminosavat kapunk.[5]
Az Adolph Strecker által 1850-ben megtervezett eredeti szintézisben racém α-aminonitril keletkezik, de az utóbbi időben számos, királis segédanyagot[6] vagy aszimmetrikus katalizátorokat[7][8] használó eljárást fejlesztettek ki.
Reakciómechanizmus
A szintézis vázlatos reakciómechanizmusa a következő. A szintézis első felében az 1.1 aldehidből nukleofil addíciós reakcióban ammónia hatására az 1.3 félaminál keletkezik, melyből vízkilépéssel és protonfelvétellel az 1.5 iminiumion jön létre. A cianidion nukleofil addíciós reakciójával az 1.6 aminonitril keletkezik.
 |  | |
| Strecker-szintézis 1. rész | Strecker-szintézis 2. rész |
A szintézis második felében egy proton aktiválja a 2.1 aminonitrilt, így két molekula víz nukleofil addíciójával a 2.6 köztiterméket kapjuk, melyből ammónia és proton eliminációjával jön létre a 2.7 végtermék.
Alkalmazás
A Strecker-szintézis egyik jelenlegi felhasználása egy L-valin származék több kilogrammos léptékben történő előállítása 3-metil-2-butanonból kiindulva.:[9][10]
Hivatkozások
- ↑ Strecker, A. (1850). „Ueber die künstliche Bildung der Milchsäure und einen neuen, dem Glycocoll homologen Körper”. Annalen der Chemie und Pharmazie 75 (1), 27–45. o. DOI:10.1002/jlac.18500750103.
- ↑ Strecker, A. (1854). „Ueber einen neuen aus Aldehyd - Ammoniak und Blausäure entstehenden Körper (p )”. Annalen der Chemie und Pharmazie 91 (3), 349–351. o. DOI:10.1002/jlac.18540910309.
- ↑ Kendall, E. C.; McKenzie, B. F. Organic Syntheses, Coll. Vol. 1, p.21 (1941); Vol. 9, p.4 (1929). (Article)
- ↑ Clarke, H. T.; Bean, H. J. Organic Syntheses, Coll. Vol. 2, p.29 (1943); Vol. 11, p.4 (1931). (Article)
- ↑ Masumoto, S.; Usuda, H.; Suzuki, M.; Kanai, M.; Shibasaki, M. J. Am. Chem. Soc. 2003, 125(19), 5634-5635. (doi:10.1021/ja034980+)
- ↑ Davis, F. A. et al. Tetrahedron Lett. 1994, 35, 9351.
- ↑ Ishitani, H.; Komiyama, S.; Hasegawa, Y.; Kobayashi, S. J. Am. Chem. Soc. 2000, 122(5), 762-766. (doi:10.1021/ja9935207)
- ↑ Huang, J.; Corey, E. J. Org. Lett. 2004, 6(26), 5027-5029. (doi:10.1021/ol047698w)
- ↑ A Concise Synthesis of (S)-N-Ethoxycarbonyl--methylvaline Jeffrey T. Kuethe, Donald R. Gauthier, Jr., Gregory L. Beutner, and Nobuyoshi Yasuda J. Org. Chem., 72 (19), 7469 -7472, 2007. doi:10.1021/jo7012862
- ↑ A 3-metil-2-butanon nátrium-cianiddal és ammóniával nyert termékét L-borkősavval rezolválják. Az aminosavat diciklohexilaminnal képzett sója formájában izolálják.
Fordítás
Ez a szócikk részben vagy egészben a Strecker amino acid synthesis című angol Wikipédia-szócikk ezen változatának fordításán alapul. Az eredeti cikk szerkesztőit annak laptörténete sorolja fel. Ez a jelzés csupán a megfogalmazás eredetét és a szerzői jogokat jelzi, nem szolgál a cikkben szereplő információk forrásmegjelöléseként.










