Fluorid arseničný
| Fluorid arsenitý | |
|---|---|
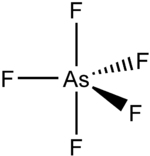 Strukturní vzorec | |
 Model molekuly | |
| Obecné | |
| Systematický název | Fluorid arseničný |
| Anglický název | Arsenic pentafluoride (systematický název) Arsenic(V) fluoride Arsorane, pentafluoro- |
| Německý název | Arsen(V)-fluorid |
| Sumární vzorec | AsF5 |
| Vzhled | bezbarvý plyn |
| Identifikace | |
| Registrační číslo CAS | 7784-36-3 |
| PubChem | 82223 |
| ChEBI | 30530 |
| SMILES | F[As](F)(F)(F)F |
| InChI | InChI=1S/AsF5/c2-1(3,4,5)6 1/AsF5/c2-1(3,4,5)6 |
| Vlastnosti | |
| Molární hmotnost | 169,913 6 g/mol |
| Teplota tání | −79,8 °C |
| Teplota varu | −52,8 °C |
| Hustota | 2,138 g/cm3 |
| Rozpustnost v nepolárních rozpouštědlech | rozpustný v benzenu |
| Bezpečnost | |
 GHS04  GHS06  GHS09 Nebezpečí[1] | |
| R-věty | R23/25, R50/53 |
| S-věty | S1/2, S20/21, S28, S45, S60, S61 |
| NFPA 704 |  0 4 1 |
Není-li uvedeno jinak, jsou použity jednotky SI a STP (25 °C, 100 kPa). Některá data mohou pocházet z datové položky. | |
Fluorid arseničný je chemická sloučenina arsenu a fluoru se vzorcem AsF5.
Výroba
Fluorid arseničný se vyrábí reakcí arsenu a fluoru v přesném poměru (pokud by bylo méně fluoru, vznikal by také fluorid arsenitý):
2 As + 5 F2 → 2 AsF5.
Lze jej také vyrobit slučováním fluoridu arsenitého s fluorem:
AsF3 + F2 → AsF5.
Vlastnosti a struktura
Za normálních podmínek je AsF5 bezbarvý plyn, jehož molekula má tvar trigonální bipyramidy (dva trojboké jehlany se společnou podstavou).
V pevném skupenství jsou délky osních vazeb (dvě sousední svírají pravý úhel As-F 171,9 pm a délky zbylých dvou vazeb jsou 166,8 pm.
Reakce
Fluorid arseničný vytváří halogenidové komplexy, například s fluoridem siřičitým tvoří iontový komplex[2]:
AsF5 + SF4 → SF3+ + AsF6−.
Bezpečnost
Fluorid arseničný je prudký jed, který nejvíce poškozuje jaterní buňky. Má zřetelný zápach podobný zápachu plynného vinylchloridu.
Podobné sloučeniny
Reference
V tomto článku byl použit překlad textu z článku Arsenic pentafluoride na anglické Wikipedii.
- ↑ a b Arsenic pentafluoride. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-23]. Dostupné online. (anglicky)
- ↑ An investigation of the structures of the adducts of SF4 with BF3, PF5, AsF5, and SbF5 in the solid state and in solution in HF, M. Azeem, M. Brownstein, and R. J. Gillespie Can. J. Chem. 47(22): 4159–4167 (1969), DOI:10.1139/v69-689Je zde použita šablona
{{DOI}}označená jako k „pouze dočasnému použití“.
Externí odkazy
 Obrázky, zvuky či videa k tématu Fluorid arseničný na Wikimedia Commons
Obrázky, zvuky či videa k tématu Fluorid arseničný na Wikimedia Commons
 | Tento článek je příliš stručný nebo postrádá důležité informace. Pomozte Wikipedii tím, že jej vhodně rozšíříte. Nevkládejte však bez oprávnění cizí texty. |
| Fluoridy s prvkem v oxidačním čísle V. | |
|---|---|
| Fluorid arseničný (AsF5) • Fluorid zlatičný (Au2F10) • Fluorid bismutičný (BiF5) • Fluorid bromičný (BrF5) • Fluorid chlorečný (ClF5) • Fluorid chromičný (CrF5) • Fluorid jodičný (IF5) • Fluorid iridičný (IrF5) • Fluorid manganičný (MnF5) • Fluorid molybdeničný (MoF5) • Fluorid dusičný (NF5) • Fluorid niobičný (NbF5) • Fluorid neptuničný (NpF5) • Fluorid osmičný (OsF5) • Fluorid fosforečný (PF5) • Fluorid protaktiničný (PaF5) • Fluorid platiničný (PtF5) • Fluorid plutoničný (PuF5) • Fluorid rheničný (ReF5) • Fluorid rhodičný (RhF5) • Fluorid rutheničný (RuF5) • Dekafluorid disíry (S2F10) • Fluorid antimoničný (SbF5) • Fluorid tantaličný (TaF5) • Fluorid technecičný (TcF5) • Fluorid uraničný (U2F10) • Fluorid vanadičný (VF5) • Fluorid wolframičný (WF5) | |







